| Le complexe hypothalamo-adénohypophysaire-organes cibles | ||
|---|---|---|
| Précédent | Le complexe hypothalamo-hypophysaire des Mammifères et son fonctionnement | Suivant |
Si l’hypothalamus et l’adénohypophyse ne sont pas reliés par voie nerveuse, au contraire de l’hypothalamus et de la neurohypophyse, ils sont reliés par voie circulatoire grâce au système porte hypothalamo-hypophysaire.
Quelles sont les conséquences fonctionnelles d’un tel agencement ?
La production d’hormones glandulotropes contrôlant le fonctionnement de glandes endocrines
L’adénohypophyse est constituée de multiples cellules endocrines distinctes par leurs dimensions, leurs localisations, leurs propriétés tinctoriales et la nature des molécules qu’elles synthétisent.
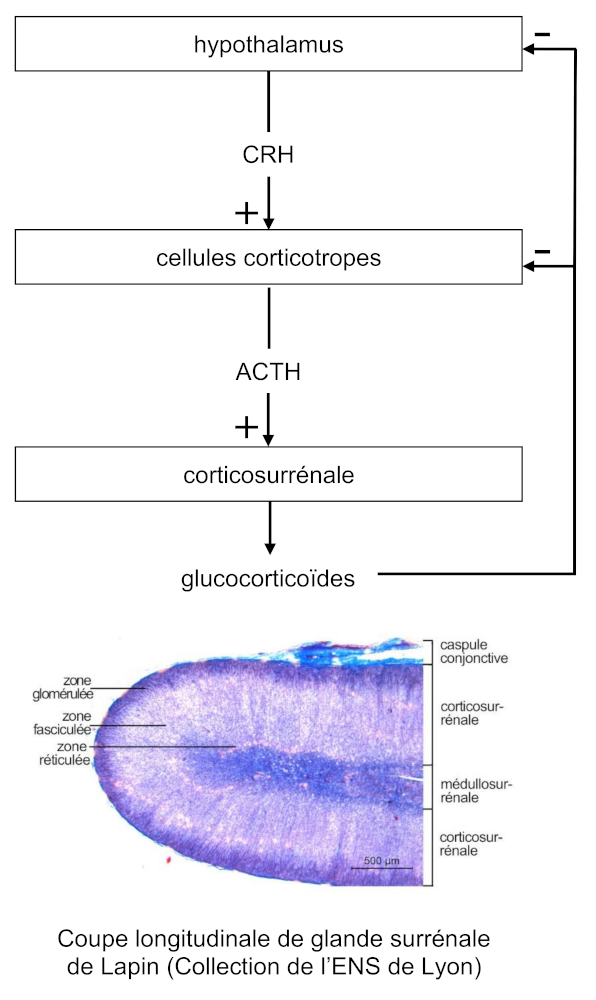
Les cellules corticotropes produisent une hormone appelée corticostimuline, également désignée par le terme corticotrophine et l’acronyme ACTH (adrenocorticotrophic hormone).
En présence de corticostimuline les glandes corticosurrénales, formant la région périphérique des glandes surrénales, produisent et libèrent dans le sang des molécules comme le cortisol, l’aldostérone ainsi que des androgènes. En raison de leur origine, elles sont qualifiées de corticoïdes.
Les glandes corticosurrénales sont formées de trois régions. De la périphérie vers le centre, ce sont :
- la zone glomérulée, élaborant l’aldostérone, minéralocorticoïde impliqué dans le contrôle de l’équilibre ionique ;
- la zone fasciculée, produisant principalement du cortisol, glucocorticoïde jouant un rôle dans le contrôle du métabolisme ;
- la zone réticulée, synthétisant essentiellement des androgènes.
L’action de la corticostimuline sur les cellules cibles de la glande corticosurrénale implique une fixation sur des récepteurs membranaires conduisant à la synthèse d’un second messager, l’AMPc. Il provoque l’activation d’enzymes transformant le cholestérol en précurseur des hormones corticoïdes.
La libération de la corticostimuline par les cellules corticotropes est pulsatile et obéit à un rythme circadien, elle est ainsi plus élevée en fin de nuit.
Elle est stimulée par un facteur hormonal sécrété par l’hypothalamus, appelé corticolibérine, également désigné par l’acronyme CRH (corticotropin releasing hormone).
Comment expliquer la sécrétion rythmique ?
La corticostimuline stimule la sécrétion des hormones par la glande corticosurrénale. Lorsque leurs concentrations plasmatiques, et notamment celle du cortisol, sont élevées, elles provoquent une diminution de la libération de corticolibérine par l’hypothalamus et de corticostimuline par l’hypophyse.
Ces processus sont appelés rétrocontrôles négatifs. La réduction de la libération de corticolibérine hypothalamique entraîne une amplification de la diminution de la libération de corticostimuline. En conséquence, la concentration plasmatique de corticostimuline atteint un niveau très faible, au début de la nuit. En absence de stimulation par la corticostimuline, la sécrétion des hormones par la glande corticosurrénale diminue ainsi que leurs concentrations plasmatiques. Le rétrocontrôle négatif s’affaiblissant, la libération de corticolibérine hypothalamique et de corticostimuline hypophysaire reprend de sorte que la concentration plasmatique de la seconde est élevée en fin de nuit.
Copyright : 2019 – Eva Brunon ; Pauline Defour ; Justine Fayolle ; Anaëlle Joassard
Cette illustration est mise à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Partage dans les mêmes conditions 4.0 International.

Ainsi, l’hypothalamus produit une neurohormone, la corticolibérine, déversée dans les vaisseaux sanguins capillaires du système porte hypothalamo-hypophysaire. Elle agit sur les cellules corticotropes de l’hypophyse, stimulant la sécrétion de l’hormone qu’elles synthétisent, la corticostimuline. Libérée dans le sang, elle contrôle le fonctionnement de la glande corticosurrénale, dont elle augmente l’activité, en l’occurrence la production d’hormones corticoïdes, qui exercent en retour un rétrocontrôle négatif sur l’hypothalamus et les cellules corticotropes de l’hypophyse.
À l’instar de l’hypothalamus et la neurohypophyse, l’hypothalamus et l’adénohypophyse forment un complexe fonctionnel.
Son fonctionnement implique une communication hormonale par voie sanguine, empruntant le système porte hypothalamo-hypophysaire. Les neurohormones hypothalamiques agissent directement sur les cellules endocrines de l’adénohypophyse, sans être préalablement distribuées dans l’ensemble de l’organisme. Les hormones hypophysaires contrôlent pour leur part l’activité de glandes endocrines périphériques, elles sont qualifiées de glandulotropes.
Outre la glande corticosurrénale, d’autres glandes endocrines périphériques sont intégrées dans un axe hypothalamo-adénohypophysaire.
Copyright : 2019 – Eva Brunon ; Pauline Defour ; Justine Fayolle ; Anaëlle Joassard
Cette illustration est mise à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Partage dans les mêmes conditions 4.0 International.

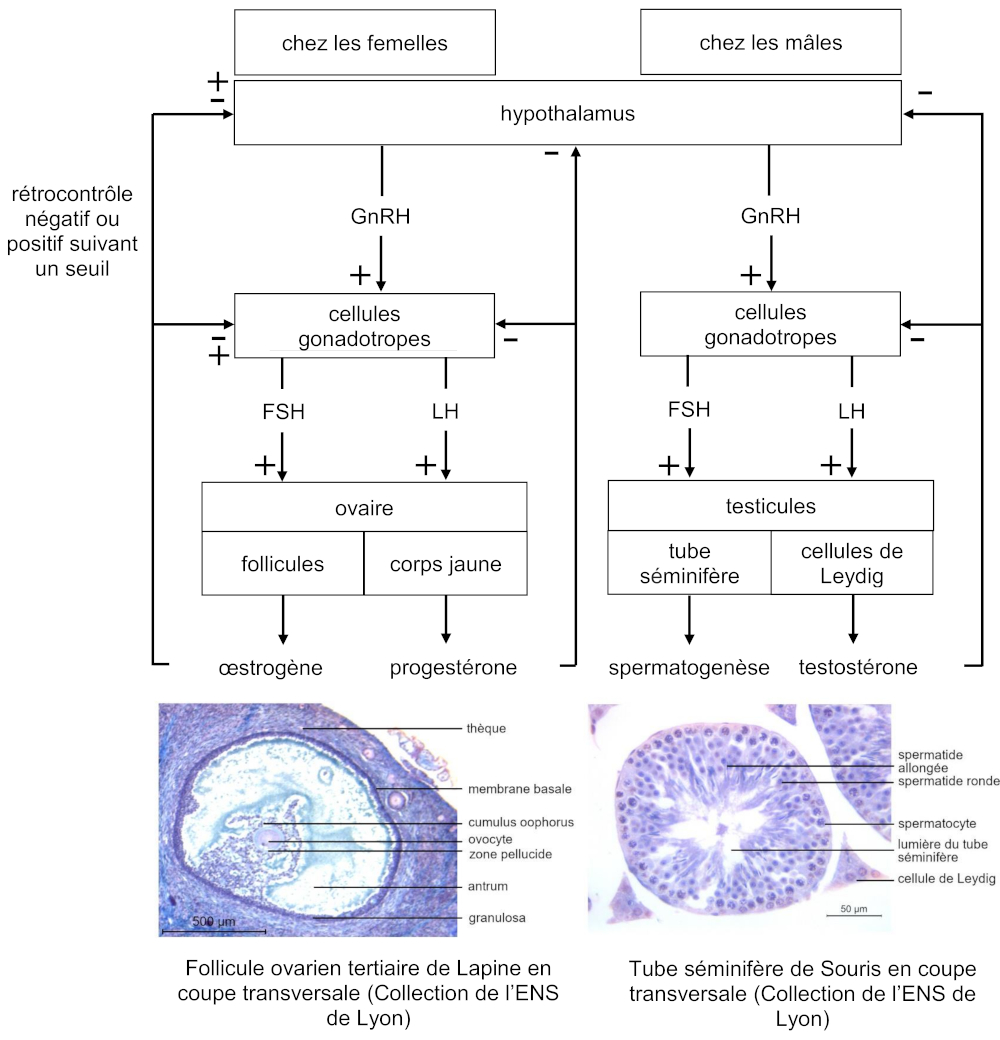
Parmi les cellules endocrines de l’adénohypophyse figurent les cellules gonadotropes produisant des hormones appelées gonadostimulines ou gonadotrophines : la FSH (follicle stimulating hormone), hormone folliculostimulante, et la LH (luteinizing hormone), hormone lutéinisante.
Schématiquement, chez la femelle l’hormone folliculostimulante et l’hormone lutéinisante stimulent la production d’œstrogènes par les follicules ovariens et la production de progestérone par le corps jaune. Toutes deux ont par ailleurs des actions directes sur les follicules ovariens, favorisant leur croissance et leur transformation en corps jaunes, l’hormone lutéinisante déclenchant par ailleurs l’ovulation.
Chez le mâle, l’hormone folliculostimulante agit sur les cellules de Sertoli et stimule la production d’inhibine tout en favorisant la spermatogenèse. L’hormone lutéinisante stimule la production de testostérone par les cellules de Leydig du testicule.
De la même manière que dans l’axe hypothalamus-adénohyophyse-glande corticosurrénale, la libération des gonadostimulines par l’hypophyse est contrôlée par une hormone hypothalamique, la gonadolibérine également désignée par l’acronyme GnRH (gonadotropin releasing hormone).
Œstrogènes et progestérone libérés par les ovaires exercent un rétrocontrôle négatif pendant la phase préovulatoire du cycle ovarien, puis un rétrocontrôle positif à l’origine d’une décharge d’hormone lutéinisante provoquant l’ovulation. Le rétrocontrôle négatif reprend pendant la phase postovulatoire.
Testostérone et inhibine libérées par les testicules en réponse à la stimulation par les hormones folliculostimulante et lutéinisante exercent un rétrocontrôle négatif sur les cellules gonadotropes de l’hypophyse et sur l’hypothalamus.
Finalement, le principe du fonctionnement de l’axe hypotalamus-adénohypophyse- gonades est semblable à celui de l’axe hypothalamus-adénohyophyse-glande corticosurrénale. Toutefois, les gonadostimulines exercent également une action directe sur les gonades.
Copyright : 2019 – Eva Brunon ; Pauline Defour ; Justine Fayolle ; Anaëlle Joassard
Cette illustration est mise à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Partage dans les mêmes conditions 4.0 International.

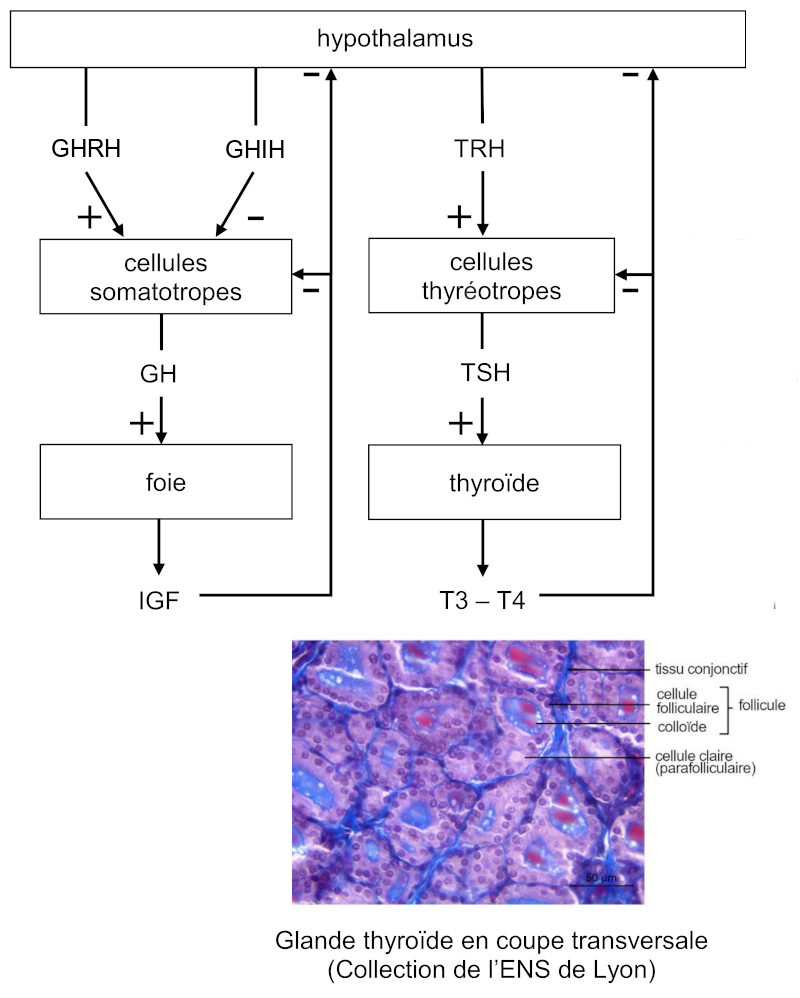
Les cellules somatotropes de l’adénohypophyse produisent l’hormone de croissance, appelée somatostimuline, somatotrophine et également désignée par les acronymes STH (somatotropic hormone) et GH (growth hormone).
Elle stimule la production de somatomédine C, ou IGF (insulin-like growth factor), par le foie, hormone agissant notamment sur le cartilage dont elle provoque la croissance.
L’activité des cellules somatotropes est contrôlée par deux hormones hypothalamiques antagonistes, la somatolibérine ou GHRH (growth hormone releasing hormone) et la somatostatine ou GHIH (growth hormone release inhibiting hormone) stimulant et inhibant respectivement la sécrétion de somatostimuline par l’adénohypophyse.
Parallèlement la somatomédine C exerce un rétrocontrôle négatif sur la libération de somatostimuline par l’adénohypophyse et de somatolibérine par l’hypothalamus de sorte que la sécrétion de somatostimuline est pulsatile.
Les cellules thyréotropes pour leur part synthétisent la thyréostimuline ou thyréotrophine, également désignée par l’acronyme TSH (thyroid stimulating hormone), stimulant l’activité de la glande thyroïde.
En réponse elle libère les hormones thyroïdiennes, T3 (triiodothyronine) et T4 (tétraiodothyronine), contrôlant la croissance et le métabolisme.
L’activité des cellules thyréotropes est stimulée par une hormone hypothalamique, la thyréolibérine ou TRH (thyreotropin releasing hormone) et inhibée par les hormones thyroïdiennes en raison d’un rétrocontrôle négatif s’exerçant de même sur l’hypothalamus.
Ainsi, l’adnohypophyse sécrète divers hormones glandulotropes, la corticostimuline (ACTH), les gonadostimuline (FSH et LH), la somatostimuline (GH) et la thyréostimuline (TSH). Elles agissent sur les glandes endocrines périphériques dont elles stimulent l’activité, respectivement la glande corticosurrénale, les cellules endocrines des gonades, le foie et la glande thyroïde.
Les neurones de l’hypothalamus pour leur part sécrètent des neurohormones contrôlant l’activité des cellules de l’adénohypophyse. Ce sont la corticolibérine, la gonadolibérine, la somatolibérine et la thyréolibérine qui stimulent la libération des stimulines hypophysaires, et la somatostatine qui a une action inhibitrice. Elles sont libérées dans le système porte hypothalamo-hypophysaire.
De manière générale, les neurones hypothalamiques et les cellules adénohypophysaires subissent un rétrocontrôle négatif exercé par les hormones des glandes endocrines périphériques de sorte que la production hormonale est en permanance ajustée.
Cependant, les hormones adénohypophysaires agissent parfois directement sur des organes effecteurs, à l’instar des gonadostimulines voire de la somastimuline.
La production d’hormones effectrices
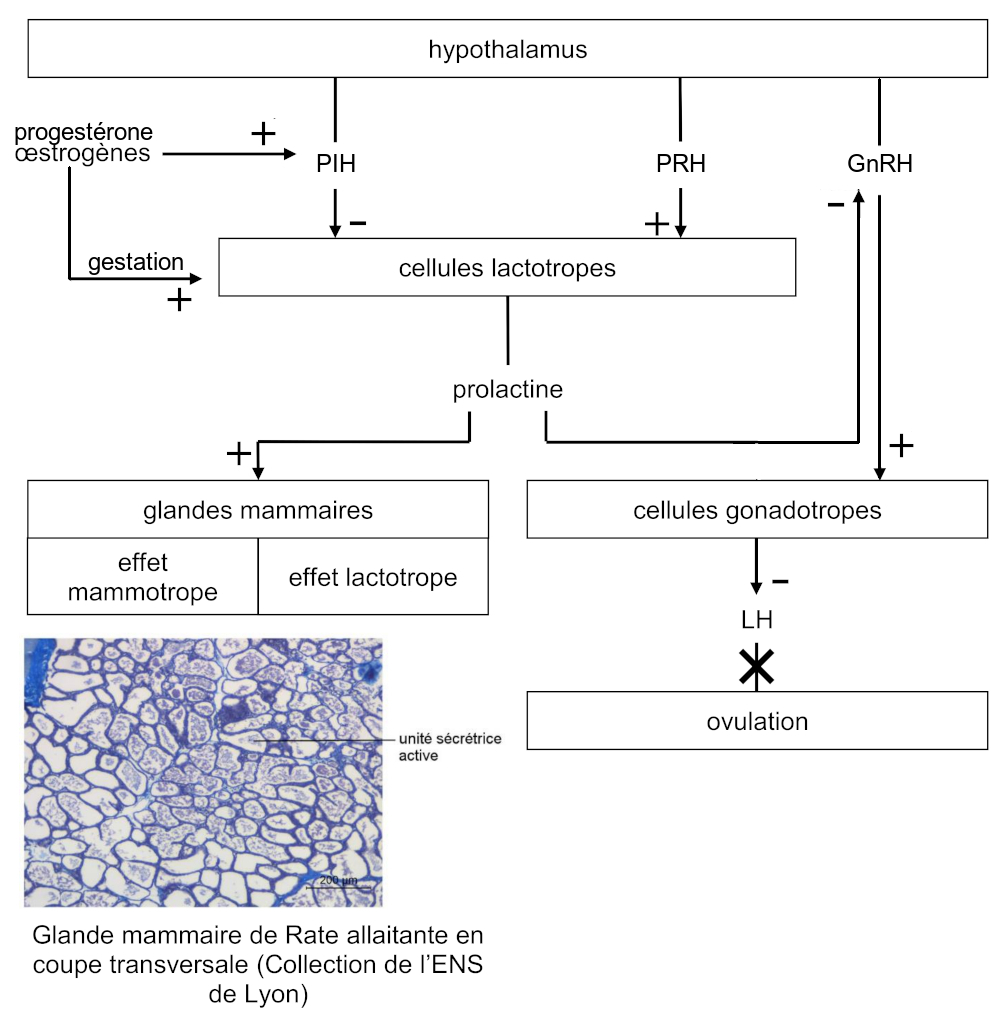
L’adénohypophyse contient des cellules lactotropes produisant une hormone appelée prolactine, lactostimuline ou mammotrophine. Elle stimule la prolifération et la différenciation des cellules sécrétrices des mamelles pendant la gestation, ainsi que la production des constituants du lait après la parturition. Durant la lactation, la prolactine provoque une diminution de la sécrétion de gonadolibérine, induisant une diminution de la concentration plasmatique d’hormone lutéinisante, qui inhibe l’ovulation.
La sécrétion de prolactine par les cellules lactotropes est pulsatile, suit un rythme circadien et le cycle ovarien. La sécrétion est élevée la nuit, pendant la gestation et en période de lactation, elle est alors stimulée par la succion du mamelon.
L’activité des cellules lactotropes hypophysaires est contrôlée par une neurohormone hypothalamique inhibitrice, la PIH (prolactin release inhibiting hormone) correspondant à la dopamine, et une neurohormone hypothalamique stimulatrice, la PRH (prolactin releasing hormone).
Un contrôle périphérique intervient également, la progestérone et les œstrogènes inhibent sa sécrétion en stimulant la libération de la neurohormone hypothalamique inhibitrice. En revanche, lors de la gestation les œstrogènes semblent agir directement sur les cellules lactotropes, stimulant la production de prolactine.
Copyright : 2019 – Eva Brunon ; Pauline Defour ; Justine Fayolle ; Anaëlle Joassard
Cette illustration est mise à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Partage dans les mêmes conditions 4.0 International.

Ainsi, l’adénohypophyse sécrète une hormone agissant directement sur des organes effecteurs, sous le contrôle de l’hypothalamus.
Le cas de la prolactine est original à plusieurs titres : le contrôle hypothalamique de sa sécrétion par les cellules lactotropes est principalement inhibiteur, et elle n’exerce pas de rétrocontrôle négatif sur l’hypothalamus ou l’hypophyse.
Une seconde hormone adénohypophysaire agit directement sur un effecteur.
Copyright : 2019 – Eva Brunon ; Pauline Defour ; Justine Fayolle ; Anaëlle Joassard
Cette illustration est mise à disposition selon les termes de la Licence Creative Commons Attribution – Pas d’Utilisation Commerciale – Partage dans les mêmes conditions 4.0 International.

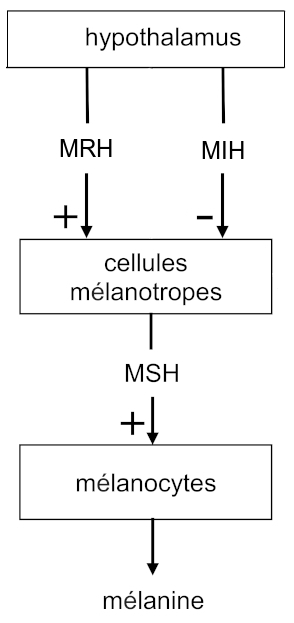
Les cellules mélanotropes de l’adénohypophyse sécrètent la mélanostimuline ou mélanotrophine, également appelée MSH (melanocyte stimulating hormone), agissant sur les mélanocytes tégumentaires. Elle provoque la synthèse et la dispersion de la mélanine, pigment brun-noir colorant le tégument.
La sécrétion de mélanostimuline est contrôlée par une mélanolibérine et une mélanostatine hypothalamiques, respectivement désignées par les acronymes MRH (MSH releasing hormone) et MIH (MSH release inhibiting hormone).